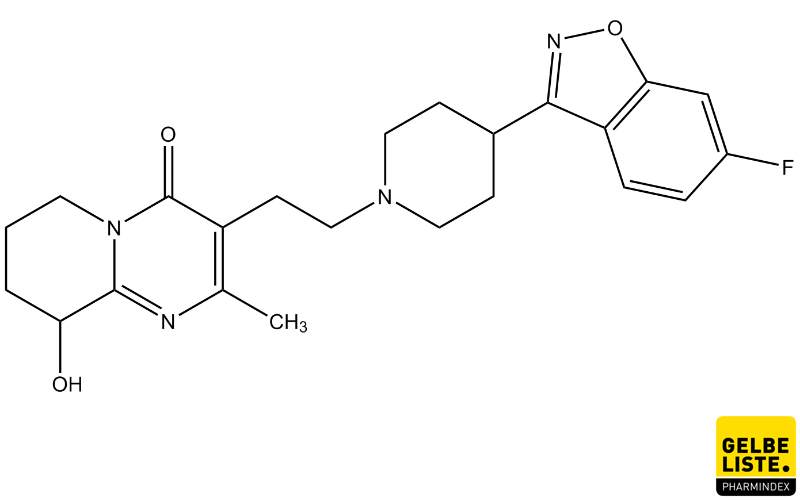
Latrepirdin oder Dimebolin (russischer Freiname) ist ein Arzneistoff aus der Gruppe der Antihistaminika, der zur Behandlung von allergischen Reaktionen eingesetzt wird. Der Wirkstoff ist bislang nur in Russland und anderen Nachfolgestaaten der ehemaligen Sowjetunion als Bestandteil von Arzneimitteln zugelassen.
Klinische Angaben
Anwendungsgebiete
Zugelassene Anwendungsgebiete
In den Nachfolgestaaten der Sowjetunion ist Latrepirdin zur Behandlung von Heuschnupfen, Nesselsucht, Nahrungsmittel-, Kosmetik-, Hausstaub- oder Arzneimittelallergie, Quincke-Ödem, atopischen Ekzemen bei Hausstauballergie, bei allergischen und entzündlichen Erkrankungen des Auges, entzündlichen Reaktionen bei Verbrennungen sowie bei Neurodermitis und anderen Ekzemen zugelassen.
Weitere mögliche Anwendungsgebiete
Latrepirdin wird gegenwärtig als mögliche Behandlung in den Anwendungsgebieten Alzheimersche Krankheit und Chorea Huntington untersucht. Eine behördliche Zulassung für den Einsatz bei diesen Krankheiten besteht jedoch nicht.
Gegenanzeigen
Latrepirdin darf nicht bei Überempfindlichkeit gegen den Wirkstoff, in der Schwangerschaft sowie in der Stillzeit angewendet werden.
Wechselwirkungen mit anderen Medikamenten
Bei gleichzeitiger Einnahme von Latrepirdin mit Schlafmitteln, Anxiolytika, Antidepressiva, Antipsychotika oder Opioiden kann es zu einer gegenseitigen Verstärkung der Wirkungen auf das Zentralnervensystem kommen.
Unerwünschte Wirkungen
Bekannte Nebenwirkungen sind Mundtrockenheit, Taubheitsgefühl auf der Mundschleimhaut, Schläfrigkeit und verminderte Konzentrationsfähigkeit.
Wirkungsmechanismus
Die Wirkungen des Latrepirdin auf H1Histamin-Rezeptoren wurden bereits in den 1980er Jahren beschrieben. Ebenfalls in den 1980ern wurden Hemmwirkungen auf die Monoaminooxidase Typ B beschrieben. Der Wirkstoff soll ebenfalls die Durchlässigkeit von Blutgefäßwänden vermindern sowie lokalanästhetische und sedierende Wirkungen haben.
2000 wurden Tacrin-ähnliche Wirkungen auf das Lernverhalten in Alzheimer-Tiermodellen beschrieben. Die gleiche Arbeitsgruppe legte 2001 Untersuchungsergebnisse vor, die Hemmwirkungen für die Acetylcholinesterase, am NMDA-Rezeptor sowie an Calciumkanälen beschreiben. Weiterhin soll Latrepirdin ein Antagonist des 5-ht6-Serotoninrezeptors sein. Der zelluläre Angriffspunkt des Latrepirdin sollen die Mitochondrien sein. Latrepirdin wirkt zudem als FIASMA (funktioneller Hemmer der sauren Sphingomyelinase).
Nach der klinischen Validierung der Wirkung des Latrepirdin bei Patienten mit Alzheimerscher Krankheit, beschrieb eine US-amerikanische Arbeitsgruppe, dass der Wirkstoff die Konzentration von Beta-Amyloid im Hirn von Nagetieren erhöhen würde. Diese Beobachtung könnte die bisherige Beta-Amyloid-Hypothese zur Entstehung von Alzheimer infrage stellen.
Entwicklungsgeschichte
Die erste Erwähnung von Latrepirdin in der zugänglichen Literatur stammt aus dem Jahr 1971. Der Arzneistoff wurde anscheinend aber schon in den 1960er Jahren in der Sowjetunion synthetisiert und dort 1983 erstmals als Bestandteil eines Arzneimittels zugelassen. Im Jahr 2000 wurden neuroprotektive Wirkungen durch russische Wissenschaftler beschrieben. Diese Beobachtung wurde ein Jahr später durch erste klinische Erfahrungen bei Alzheimer-Patienten ergänzt.
Die US-amerikanische Firma Medivation sicherte sich 2003 Rechte an der Entwicklung des Wirkstoffs. Die klinischen Arbeiten begannen 2005 für Alzheimer und 2007 für Huntington. Die positiven Ergebnisse der ersten größeren Alzheimer-Studie wurden 2008 in der Zeitschrift Lancet veröffentlicht.
Seit 2008 wurde Latrepirdin gemeinsam von den Firmen Medivation und Pfizer zur Behandlung von Alzheimer und Chorea Huntington untersucht. Die Untersuchungen zum Wirkstoff erreichten Phase III. Mitte 2009 gaben die Hersteller bekannt, dass der ursprünglich unter dem russischen Freinamen Dimebolin bekannte Wirkstoff den internationalen Freinamen Latrepirdin erhalten wird und von der US-amerikanischen Arzneimittelbehörde als Entwicklungskandidat zur Behandlung seltener Erkrankungen für die Indikation Chorea Huntington anerkannt wurde. Im März 2010 wurde bekannt, dass eine der Zulassungsstudien im Anwendungsgebiet Alzheimer negativ ausging. Im Juni 2010 erklärten die beiden Herstellerfirmen, dass zwei weitere Phase-III-Studien im Zusammenhang mit der Behandlung von Alzheimer gestartet wurden.
Im Januar 2012 gab die Firma Pfizer bekannt, dass die weitere klinische Entwicklung von Latrepirdin eingestellt wird. Grund hierfür seien unbefriedigende Studienergebnisse, die die ersten positiven Resultate nicht bestätigen konnten.
Handelsnamen
Latrepirdin wird in Russland und anderen Nachfolgestaaten der ehemaligen Sowjetunion unter dem Handelsnamen Dimebon (Hersteller: Organika) vertrieben und ist dort verschreibungspflichtig.
Weblinks
- Einträge im NIH-Studienregister
Einzelnachweise